多路复用受激发射损耗纳米显微技术用于多色活细胞长期成像
在细胞生物学领域,越来越多的研究集中于亚细胞结构之间错综复杂的相互作用网络。超分辨率荧光显微镜作为一种强大的成像工具,突破了衍射极限,使生物学家能够以纳米级分辨率观察亚细胞结构。在超分辨率荧光显微镜中,受激发射损耗显微镜 (STED) 是超越衍射极限的领先技术之一,它通过即时的超分辨率显微镜特性确保了最少的伪影,无需后处理。
近十年来,研究亚细胞结构间相互作用的需求导致人们对多色活细胞 STED 的兴趣和应用日益增加,最传统的方法是使用多个激发-耗尽光束对来实现。然而,增加耗尽光束的数量不仅使系统更加复杂,大大增加了构建成本,而且还增加了光漂白和更严重的光细胞毒性的可能性,这不利于活细胞成像。另一方面,使用单个耗尽光束和多个激发光束会限制可用的激发波长范围,将受限波段划分为多个密集排列的光谱通道并减少它们之间的串扰是一项重大挑战。目前,这种方法通常仅限于两色或三色成像。
因此,研究人员利用荧光寿命信息实现多色成像。荧光寿命是荧光分子处于激发态的平均时间,可用于区分不同的荧光分子。然而,基于荧光寿命的多色 STED 目前仅适用于固定细胞,因为 (i) 筛选出具有适合 STED 成像的亮度和抗漂白特性的活细胞荧光标记物、(ii) 同时标记活细胞中的多个亚细胞结构以及 (iii) 使用适当的分析方法在同一光谱通道中分离不同的荧光探针存在困难。目前,生物学家面临使用 STED 显微镜研究亚细胞结构动力学和功能的有效方法不足。
基于上述挑战,本文作者开发了多路复用受激发射损耗纳米显微技术(mSTED),该技术可以同时观察更多结构,同时降低光漂白和光毒性。研究人员筛选了一系列合适的荧光探针组合,能够同时标记多个亚细胞结构。随后通过相量分析分离这些具有相似光谱特性的活细胞荧光探针。mSTED 实现了 5 色活细胞 STED 成像,并揭示了不同亚细胞结构之间的长期相互作用。该研究结果为理解活细胞中亚细胞结构复杂而微妙的相互作用组提供了一种途径。
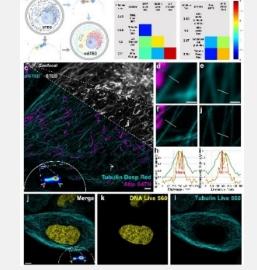
研究人员首先通过双色成像测试了 mSTED 的性能(图 1),结果表明它可以成功分离不同的亚细胞结构,并且仅引起 4% 的串扰。与共聚焦显微镜相比,mSTED 的分辨率显著提高(~60 nm),能够更精细地观察亚细胞结构。
为了验证mSTED在光漂白和光细胞毒性方面的表现,研究人员对mSTED与传统的多色STED方法进行了对比分析(图2)。传统的双色STED成像需要2束激光消耗,成像11分钟后,微管荧光信号下降到初始值的13.4%,线粒体变为肿胀、圆整的形状,表明光漂白和光细胞毒性较为严重。而mSTED只需要1束激光消耗,成像11分钟后,微管荧光信号仍有31.5%,线粒体形状没有发生明显变化。
研究人员利用mSTED对活细胞进行长期成像,实现了同时观察5个亚细胞结构(图3)。长期多色mSTED的大量信息使我们能够发现细胞生物学中有趣的现象。例如,微管在细胞核下方留出一些空间供其他细胞器移动,线粒体的分裂和融合就是在内质网和微管的配合下发生在这个有限的空间中。这些结果凸显了多色mSTED在长期活细胞多种结构成像中的优势,同时能够系统地解释细胞器相互作用网络。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
